Advertisement
Grab your lab coat. Let's get started
Welcome!
Welcome!
Create an account below to get 6 C&EN articles per month, receive newsletters and more - all free.
It seems this is your first time logging in online. Please enter the following information to continue.
As an ACS member you automatically get access to this site. All we need is few more details to create your reading experience.
Not you? Sign in with a different account.
Not you? Sign in with a different account.
ERROR 1
ERROR 1
ERROR 2
ERROR 2
ERROR 2
ERROR 2
ERROR 2
Password and Confirm password must match.
If you have an ACS member number, please enter it here so we can link this account to your membership. (optional)
ERROR 2
ACS values your privacy. By submitting your information, you are gaining access to C&EN and subscribing to our weekly newsletter. We use the information you provide to make your reading experience better, and we will never sell your data to third party members.
Synthesis
C&EN En Español
Resueltas estructuras diana clave para curar el cáncer
Conocer la configuración de HDAC6 podría ayudar a los investigadores en el diseño de fármacos.
by Celia Henry Arnaud
July 27, 2016
| A version of this story appeared in
Volume 94, Issue 31

La enzima HDAC6 es un “objetivo de absoluta actualidad en el campo de quimioterapia para cáncer”, según David W. Christianson, un químico de la Universidad de Pensilvania que estudia esta enzima. Formalmente conocida como histona deacetilasa 6, esta enzima es responsable de eliminar los grupos acetilo de la proteína tubulina, un componente estructural de la estructura interna de las células. Al interferir en este proceso de desacetilación, se puede interrumpir la habilidad de la célula de dividirse y transportar nutrientes, lo que conlleva finalmente a la muerte celular.

Debido a que los investigadores querrían alterar células tumorales de este modo, buscaron inhibidores de HDAC6 como potenciales tratamientos anticáncer. Hasta la fecha, han tenido que buscar a tientas sin ninguna estructura cristalina que pudiese guiarlos… pero esto acaba de cambiar.
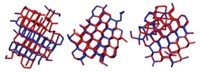
Dos grupos han resuelto de manera independiente estructuras de HDAC6 obtenida del pez cebra. Por un lado, Christianson y su estudiante de doctorado Yang Hai han descifrado una serie de estas estructuras cristalinas (Nat. Chem. Biol. 2016, DOI: 10.1038/nchembio.2134), así como una estructura de la HDCA6 humana, que sirvió para demostrar que la proteína del pez cebra puede usarse como un sustituto adecuado. La otra serie la resolvieron Patrick Matthias, del Instituto Friedrich Miescher para la Investigación Biomédica (Basilea, Suiza), y sus colaboradores (Nat. Chem. Biol. 2016, DOI: 10.1038/nchembio.2140).
Al contrario que otras histona deacetilasas, HDAC6 tiene dos dominios que catalizan la eliminación de grupos acetilo. El dominio catalítico 2 (CD2, por sus siglas en inglés) es el sitio principal de desacetilación. Por otro lado, el dominio catalítico 1 (CD1) habitualmente se define como dominio “de baja actividad”, o incluso “no activo”.
Christianson y Hai descubrieron que, a pesar de su apodo, CD1 puede ser bastante activo con el sustrato adecuado. CD1 tiene un residuo de lisina en su sitio de unión, mientras que CD2 tiene una leucina. Tras usar péptidos como sustratos para modelizar segmentos de tubulina, los investigadores averiguaron que la lisina presente en CD1 funciona como un “guardián” que bloquea el sitio activo ante cualquier sustrato excepto aquellos que tienen una lisina acetilada en su extremo carboxilato. Christianson añadió que aún no está claro por qué CD1 tiene esa especificidad en la regulación de tubulina.
Sin embargo, el equipo fue capaz de tomar capturas del mecanismo catalítico de HDAC6. Reemplazando una histidina del sitio activo de la enzima, los investigadores pudieron atrapar un intermedio tetraédrico de la reacción de desacetilación. Además, pudieron resolver estructuras de HDAC6 con varios sustratos e inhibidores.
Ambos grupos resolvieron las estructuras de los dominios catalíticos aislados. Además, el grupo de Matthias consiguió descifrar una estructura en la que CD1 y CD2 están enlazados. El conjunto de los dos dominios toma una forma elipsoidal con simetría pseudo-binaria. Según Matthias, “hay un gran área de interacción entre ambos dominios, con el conector en la parte exterior”.
El equipo de Matthias también descubrió que HDAC6 obtiene su especificidad frente a tubulina gracias a una hélice con una orientación diferente a la que se encuentra en otras HDAC, y a un triptófano flexible presente en un giro que conecta dos de las hélices de la enzima.
“Los trabajos de Matthias y Christianson establecen estructuras enzima-inhibidor útiles para impulsar el descubrimiento de nuevos fármacos”, comenta Karen N. Allen, una investigadora de enzimas de la Universidad de Boston. “Estos artículos están repletos de información importante”.
Traducción al español producida por Greco González Miera de Divulgame.org para C&EN. La versión original (en inglés) del artículo está disponible aquí.



Join the conversation
Contact the reporter
Submit a Letter to the Editor for publication
Engage with us on Twitter